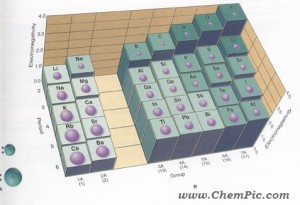
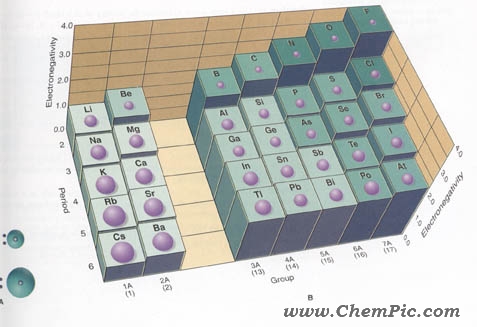
میزان تمایل یک اتم برای جذب جفت الکترونهای اشتراکی را الکترونگاتیوی آن اتم می گویند . هر چه اکترونگاتیوی یک اتم بیشتر باشد خواص فلزی آن کمتر و خواص نافلزی آن بیشتر خواهد بود . بطوریکه فلزات کمترین و نافلزات بیشترین مقدار الکترونگاتیوی را دارند .
تصویر تغییرات الکترونگاتیوی و شعاع اتمی عناصر را در دوره و گروه نشان می دهد :
#- در هر دوره از چپ به راست الکترونگاتیوی افزایش می یابد ، بنابراین در یک دوره از چپ به راست خواص فلزی کاهش و خواص نافلزی افزایش می یابد . هر دوره جدول ( بجز دوره ۱ ) با یک فلز قلیایی شروع و به یک هالوژن و گاز نجیب ختم می شود .
#- در هر گروه از بالا به پایین الکترونگاتیوی کاهش می یابد . بنابراین در هر گروه از بالا به پایین خواص فلزی افزایش و خواص نافلزی کاهش می یابد .
# – در بین تمامی عناصر فلوئور بیشترین مقدار الکترونگاتیوی و سزیم کمترین مقدار الکترونگاتیوی را دارند . فلوئور قویترین نافلز و سزیم قویترین فلز می باشد .
#- هر چه شعاع اتمی کاهش می یابد ، تاثیر هسته بر الکترونهای لایه ظرفیت بیشتر شده و الکترونگاتیوی بیشتر می شود . میتوان گفت شعاع اتمی با الکترونگاتیوی رابطه عکس دارد .
 شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی
شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی