در ترکیبات کووالانسی مولکولی ، بین اتمهای یک مولکول پیوند کووالانسی وجود دارد ، ولی بین مولکولها پیوند کووالانسی وجود ندارد ، بلکه نیروهای جاذبه ضعیف بین مولکولی وجود دارد . نیروهای جاذبه بین مولکولی از پیوندهای کووالانسی بین اتمها ضعیفتر می باشند ، لذا مولکولها به آسانی از یکدیگر جدا می شوند .
نیروهای جاذبه بین مولکولی خود به دو دسته تقسیم می شوند : نیروهای جاذبه واندروالسی و پیوند های هیدروژنی
در ترکیبات کووالانسی قطبی ( مانند هیدروژن کلرید ) نیروهای واندروالسی از نوع دوقطبی – دوقطبی است . نیروی جاذبه دوقطبی – دوقطبی در واقع نیروی جاذبه بین سر منفی یک مولکول و سر مثبت مولکول دیگر است . هر چه مولکولها قطبی تر باشند ، نیروهای جاذبه دوقطبی – دوقطبی بین آنها قویتر می باشد .
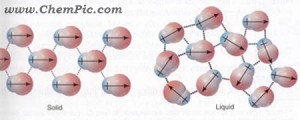
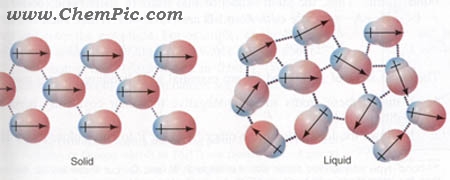
تصویر نیروهای جاذبه واندروالسی از نوع دوقطبی – دوقطبی بین مولکولهای قطبی هیدروژن کلرید (HCl) را نشان میدهد .
قطبیت هر مولکول توسط یک بردار نشان داده شده است . جهت بردار به سمت اتم با الکترونگاتیوی بیشتر ( منفی ) است . در مولکولهای هیدروژن کلرید ، اتم کلر بار منفی و اتم هیدروژن بار مثبت دارد .
شکل سمت چپ مولکولها را در حالت جامد نشان می دهد که بطور منظم کنار یکدیگر قرار گرفته اند و شکل سمت راست مولکولها را در حالت مایع نشان میدهد که مولکولها بطور نامنظم طوری کنار هم قرار گرفته اند که سر مثبت هر مولکول در مجاورت سر منفی مولکول دیگر قرار دارد .
 شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی
شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی