قدرت الکترون دهی (کاهندگی) فلزات مختلف با یکدیگر متفاوت است ، بطوریکه فلزات را میتوان بر اساس افزایش قدرت کاهندگی
مرتب نمود ، که به آن ” سری الکتروشیمیایی ” گفته میشود. در این سری فلزات بالاتر کاهنده تر می باشند.
بر اساس سری الکتروشیمیایی فلزات بالاتر ( کاهنده تر ) ، به کاتیون فلزات پایین تر در حالت محلول ، الکترون داده و آنها را بصورت فلز رسوب می دهند و خود بصورت کاتیون وارد محلول میشوند .
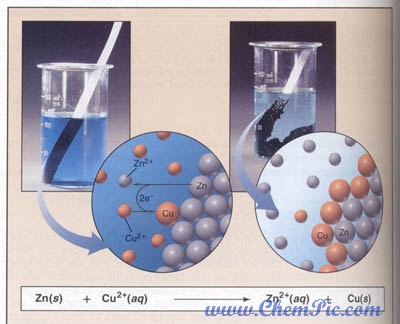
تصویر قرار گرفتن یک میله ”روی“ در محلول مس سولفات را نشان می دهد :
فلز ”روی“ کاهنده قویتری نسبت به فلز مس است ، بنابراین اتمهای ”روی“ به کاتیونهای مس موجود درون محلول الکترون داده و بصورت فلز مس رسوب میکنند و اتمهای ”روی“ بصورت کاتیون وارد محلول می شوند . بدین ترتیب یک واکنش جایگزینی ساده رخ داده و اتمهای ”روی“ جایگزین مس می شوند .
عدد اکسایش نقره و مس در این واکنش تغییر می کند.
 شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی
شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی