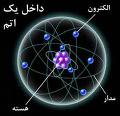
همه ی مواد از اتم ها تشکیل شده اند و اتم ها، خود از ذرات زیر اتمی مختلفی تشکیل شده اند که عمده ترین آن ها سه ذره ی پروتون، نوترون و الکترون هستند، البته باید یادآوری کرد که هر کدام از این سه ذره خود از ذرات دیگری نیز تشکیل شده اند.
پروتون(p)
جایگاه پروتون درون هسته ی اتم می باشد، این ذره که دارای جرم نسبی ۱+ می باشد، توسط رادرفورد کشف شد و یک نیروی جاذبه بسیار قوی را با نوترون ها درون هسته ی هر اتم به وجود می آورند.
پروتون ها و نوترون ها نسبت به الکترون ها بسیار سنگین تر هستند و جرم حدودی آن ها برابر است با ۱ a.m.u و برای نشان دادن عدد جرمی هر عنصر، مجموع تعداد نوترون ها و پروتون های آن را بررسی می کنیم، چون الکترون جرم بسیار کم و کوچکی دارد.
نوترون(n)
جایگاه نوترون همانند پروتون درون هسته اتم می باشد، نوترون ذره ای خنثی می باشد و جرم زیادی دارد.
تعداد نوترون ها در هسته ی اتم ها یا مساوی با تعداد پروتون هایش است یا اینکه از آن ها بیش تر می باشد.
نوترون توسط جیمز چادویک، یکی از شاگردان رادرفورد، کشف گردید
الکترون(e)
ذره ای است با بار نسبی ۱- که در اطراف هسته ی اتم در فضاهایی به نام اوربیتال و به عبارتیدر مدارهایی مجاز به نام تراز انرژی در حال گردش می باشد.
در هر اتم خنثی تعداد پروتون ها با تعداد الکترون ها برابر است و بار موثری در هسته نداریم، اگر اتمی یک الکترون از دست بدهد به یون یک بار مثبت و اگر الکترون بگیرد به یون یک بارمنفی تبدیل می گردد.
الکترون دارای دو وضعیت حرکتی است:
۱- حرکت اسپینی: گردش الکترون به دور خودش را حرکت اسپینی یا زاویه ای الکترون می گویند.
۲- حرکت اوربیتالی: حرکت الکترون در اطراف هسته ی اتم را حرکت اوربیتالی می نامند.
و طبق مکانیک کوانتومی، می دانیم که الکترون ماهیت موجی، ذره ای دارد، یعنی هم رفتار موجی دارد و هم به صورت یک ذره است.
اوربیتال(orbital)
فضایی سه بعدی در اطراف هسته اتم است که احتمال حضور الکترون در آن جا بسیار زیاد است.
هر اوربیتال را با سه عدد کوانتومی n و L و ml مشخص می کنند که n عدد کوانتومی اصلی و مشخص کننده ی شماره لایه ها است و L عدد کوانتومی اوربیتالی که مشخص کننده ی زیرلایه ها می باشد و ml که مشص کننده ی جهت گیری الکترون ها در اوربیتال می باشد.
عدد اتمی(Z)
به تعداد پروتون های یک اتم عدد اتمی آن می گویند.
عدد اتمی عناصر در سمت چپ و پایین نماد شیمیایی عناصر قرار می گیرد و مشخص کننده ی اتم و نوع عنصر و ویژگی های آن می باشد.
عدد جرمی(A)
به مجموع تعداد پروتون ها و نوترون های یک اتم عدد جرمی می گویند.
عدد جرمی در سمت چپ و بالای نماد شیمیایی عناصر قرار می گیرد.
ایزوتوپ
به اتم هایی از یک عنصر که عدد اتمی یکسان اما عدد جرمی متفاوتی دارند ایزوتوپ می گویند یا به عبارت دیگر ایزوتوپ های یک عنصر عدد اتمی، تعداد پروتون و الکترون برابر دارند اما تعداد نوترون های آن ها متفاوت است.
ایزوتون
به اتم هایی از یک عنصر که تعداد نوترون های برابری داشته باشند ایزوتون می گویند.
در ایزوتون ها، نوترون ها برابر، پروتون ها و الکترون ها متفاوت هستند.
ایزوبار
به اتم هایی از یک عنصر که عدد جرمی برابری داشته باشند، ایزوبار می گویند.
در ایزوبارها، مجموع پروتونها و نوترون ها برابر و تعداد پروتون ها نابرابر هستند.
 شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی
شیمی دبیرستان و کنکور :: Chem-Pic :: آموزش شیمی